qPCR实验简介
- 2025-03-04
- 34
qPCR是在PCR技术中加入荧光染料(SYBR Green I或TaqMan探针)的一种更高效、精准的分子生物学技术,基于PCR的原理,qPCR实现了在每一轮循环后都能观察到产物的变化情况。因此,可以对PCR进程进行实时检测。
在qPCR实验中,SYBR染料法和TaqMan探针法是一个重要的组成部分,SYBR Green I和TaqMan探针都可以使PCR过程中发出荧光信号。
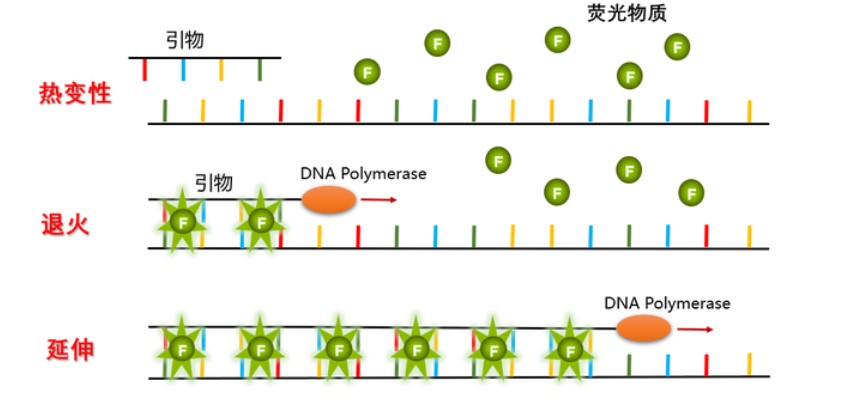
SYBR染料法利用SYBR Green I分子在游离时能发出微弱的绿色荧光,一旦结合到双链DNA的小沟区域就能发射出强烈荧光的特点,荧光信号会随着PCR产物的增加而增加,呈正比增长。
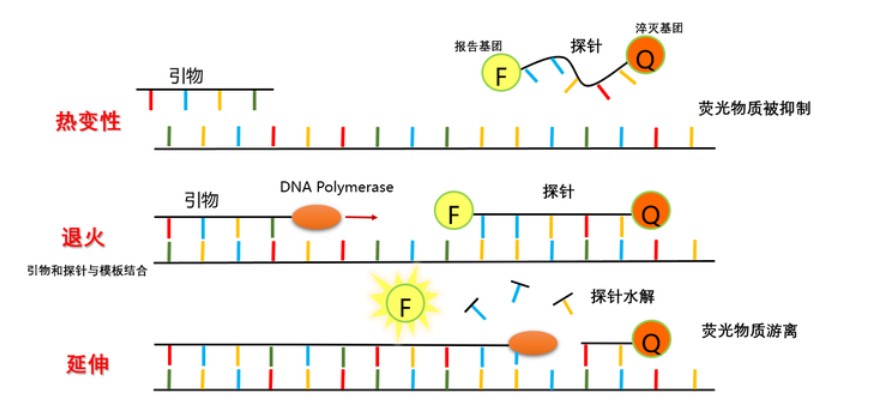
TaqMan探针法则是根据完整的TaqMan探针会发出荧光信号,只有在链延伸时,Taq酶发挥5’-3’外切酶活性水解探针,淬灭集团不发挥作用就可以检测到每一轮反应产物的生成情况。因此,qPCR技术不仅有PCR的快速、灵敏性,同时还拥有专一性、可实时监控、可精确重复性等优势。
qPCR的应用十分广泛,可以用于基因表达定量分析,甲基化检测分析、基因表达差异分析等,然而,qPCR的成功取决于所使用的引物。引物设计的一些考虑因素如GC 含量、引物二聚体或二级结构形成。有一个合适的引物是成功的开始,首先找到目的基因序列,然后借助软件Primer等,进行引物设计,引物的长度一般在18-30nt之间,引物的长度不宜过短,过短会导致产生非特异性扩增,太长则容易形成“发夹结构”;在设计引物时,要尽量跨内含子设计,这样可以减少非特异性扩增的可能,同时GC含量最好控制在40%-60%左右;设计好引物还要进行特异性验证,溶解曲线单峰且Tm>80℃即认为扩增特异性较好,一个好的引物扩增效率可以达到90%-110%。
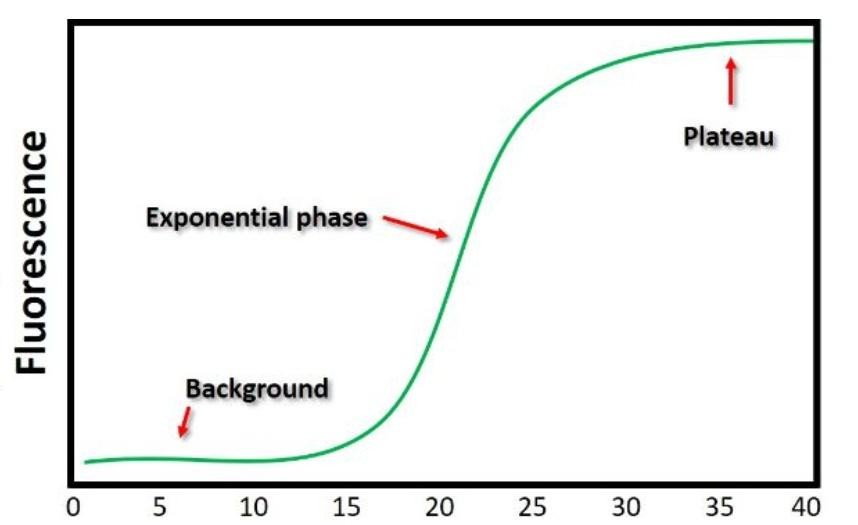
qPCR就是根据每一个循环PCR扩增反应产物的实时荧光信号变化,记录PCR产物类似于指数或S形增长的模式,直到荧光达到平台水平,每个反应槽内经历了多少次循环后荧光信号达到设定的域值,这个循环数就是Ct值;Ct 值越小,反应扩增到达平台期所需循环数越少,目的基因起始含量越高,如图。
卡梅德生物能够提供专业的qPCR实验服务,客户只需要提供实验样本和实验要求,卡梅德负责方案设计、实验和分析,最终提供针对客户项目的完整实验分析报告。
- qPCR
- 实时荧光定量
- 引物设计
- SYBR Green I
-
 400-621-6806
400-621-6806 -
 614353794
614353794 -
 周一至周五 9:00-18:00
周一至周五 9:00-18:00 -

-
 0
0
-





